Metoder til validering og verifikation af rengøringsprocedurer
Det er ikke nogen helt nem opgave at foretage validering og verifikation af rengøringsproceduren. Her præsenteres metoder til rengøringsvalideringen, som efterfølgende kan inddrages som verifikation af rengøringens effektivitet
Lovgivningsmæssigt må der ikke sælges produkter, der er potentielt sundhedsskadelige for kunderne. Derfor er det vigtigt at eliminere risici for kontaminering af produkterne. Kontaminanter kan f.eks. være:
- Fysisk kontaminering: Plast- eller metalstykker fra f.eks. udstyr
- Kemisk kontaminering: Rester af rengøringsmidler f.eks. på grund af dårligt hygiejnisk design af produktionsudstyret (revner, sprækker, dead-ends, manglende drænbarhed)
- Biologisk kontaminering: Mikroorganismer, dannede toksiner eller allergener, som primært skyldes en ikke optimeret rengøring, men sekundært kan være på grund af dårlig konstruktion af udstyr
I denne artikel vil vi koncentrere os om metoder til rengøringsvalideringen, som efterfølgende kan inddrages som verifikation af rengøringens effektivitet. Når en rengøring er blevet valideret, bliver rengøringsproceduren rutinemæssigt anvendt og der bliver herefter monitoreret og verificeret om rengøringsproceduren stadig er tilstrækkelig. En fornyet validering skal foretages ved ændringer i udstyr, processer eller procedurer, men bør også fornyes regelmæssigt, f.eks. efter ½ - 1 år års produktion eller hvis der er noget, der viser sig ikke at være i styring.
Det er vigtigt at pointere, at et fravær af kontaminanter ikke nødvendigvis skyldes en effektiv rengøring, men også kan skyldes en ikke gennemtænkt risikovurdering i forhold til enten prøveudtagning eller analyse.
Metoder til rengøringskontrol – hvilke muligheder?
Et vigtigt element i valideringen af en rengøringsprocedure er risikovurderingen af, hvad er rent nok? Og hvordan skal ”rent nok” tjekkes?Første trin bør altid være at bruge sanserne. Er udstyret visuelt rent? Også de steder, hvor det er sværere at komme til under rengøringen, og lugter det rent? Eller er der en mistænkelig mislugt, som f.eks. kan være ophobet produkter, der ligger et lidt mere ufremkommeligt sted - måske endda inde i selve udstyret.
Er udstyr ikke visuelt rent, eller er der en mistænkelig lugt, der indikerer at rengøringen ikke har været tilstrækkelig, vil det være spild af ressourcer at udtage prøver for at tjekke om rengøringen har været tilstrækkelig. Jf. figur 1, hvor et røreværk i en tank ikke er visuelt rent. I et sådant tilfælde kan det ikke svare sig at bruge ressourcerne på at udtage prøver for at følge op på om produktionsudstyret er rent – det er det ikke.

Direkte prøveudtag – oftest til åbent udstyr
Ved den direkte prøveudtagning afsvabres direkte på overfladen med en vatpind, steril klud eller et direkte aftryk. Antallet af mikroorganismer eller anden kontaminant opgives pr. undersøgt areal, f.eks. cm2.Ulempen ved disse prøveudtag er bl.a. usikkerheden, hvori det valgte sted nu også er det mest kritiske i forhold til rengøringen og er det tilstrækkelig hårdt afsvabret til at det tilbageblevne smuds / biofilm kommer med i prøven.
I et projekt i samarbejde med Danish Food Innovation (DFI) bliver den direkte prøveudtagning undersøgt i forhold til et nyt måleapparat fra SBT Instruments. Resultaterne fra denne undersøgelse bliver medtaget i en senere artikel.
Indirekte prøveudtag – oftest til lukket produktionsudstyr
Ved den indirekte prøveudtagning bliver en mængde af det sidste skyllevand udtaget, hvorefter skyllevandet undersøges for mikroorganismer eller anden kontaminant. Herved kan en større udstyrsoverflade undersøges. Det skal selvfølgelig sikres at skyllevandet har tilpas flow, og dermed mekanisk behandling af udstyrsoverfladen alle steder i det lukkede produktionsudstyr. Hvis ikke flowet er tilstrækkeligt, er der risiko for, at den udtagne prøve ikke afspejler det korrekte billede i forhold til rengøringens effektivitet.Det er ligeledes vigtigt at huske fortyndingseffekten, når der udtages en indirekte prøve. Er fortyndingseffekten stor, er det vigtigt at vælge analysemetoden med omhu, for at virksomheden får værdi af at undersøge rengøringens effektivitet. Dvs. at der rent faktisk kan detekteres noget i prøven, selvom der er sket en kraftig fortynding. Er resultatet altid under detektionsgrænsen, bør det risikovurderes, hvorvidt det er den korrekt valgte analysemetode, der anvendes.
Om det vælges at udtage en direkte eller indirekte prøve, afhænger derfor af produktionslinjen. Det vil være sværere at udtage et direkte prøveudtag, som samtidig er repræsentativ for hele den lukkede produktionslinje (rør, tanke, pumper mv.). Derimod er det oftere et indirekte prøveudtag man tyer til, ved det lukkede produktionsudstyr og direkte prøveudtagning ved det åbne produktionsudstyr.
I projektet: ”Monitorering af hygiejne i lukket produktionsudstyr” som er finansieret af Styrelsen for Innovation og Udvikling, arbejder vi bl.a. med forskellige muligheder for monitering af hygiejnen i det lukkede produktionsudstyr, som er tanke, rør, pumper mv. For at kunne måle på hygiejnen i det lukkede udstyr, er det valgt at undersøge slutskyllevandet, som dermed er en indirekte prøveudtagning. I projektet afprøves og valideres to nye forskellige rengøringsvalideringsmetoder, som er beskrevet nedenfor. I projektet er også medtaget de almindelige kendte mikrobiologiske valideringstest, så de nye metoder kan valideres op imod de kendte. Resultaterne gennemgås i en artikel i næste udgave af Plus Proces (nr. 6).
Valg af analyse
Mikroorganismer fra en biofilm der stadig er i/på udstyr efter endt rengøring, kan være i en ”viable-but-not-culturable” tilstand. Dvs. de kan vokse i det pågældende produkt og give udfordringer med både fødevaresikkerhed og produktkvalitet, men de kan ofte ikke vokse og tælles ved anvendelse af en standardtest for enten den specifikke analyse (f.eks. totalkim) eller den pågældende mikroorganisme.Er det ønsket at foretage en mikrobiologisk dyrkning og tælling, vil udfordringen ved såvel det direkte som det indirekte prøveudtag være stressede mikroorganismer, der som oftest ikke er i stand til at vokse ved standardtesten. Oftest skal disse mikroorganismer nurses, så de afstresses og dermed kan vokse frem og tælles.
Kemiske undersøgelser af slutskyllevandet giver ofte ikke samme udfordringer, som de mikrobiologiske tællinger, idet det er kemiske komponenter, der måles på og ikke levedygtige mikroorganismer.
Til måling af bakterier eller mængde af totalt organisk kulstof (TOC) i skyllevandet kan nye målemetoder, til måling af slutskyllevandet, anvendes. TOC-analysen er måling af en kemisk komponent (kulstof), mens der til målingen af bakterier anvendes en ny flowcytometriteknologi, som tæller enkelte bakterieceller. Hvilket betyder, at der ikke både er dyrkning og tælling, men udelukkende tælling. Dette eliminerer udfordringen med de stressede mikroorganismer, der ikke kan vokse ved standardtesten (”viable-but-not-culturable”). Når dyrkningstrinnet undgås, kan man opnå en meget hurtig måling og der bliver talt mange flere bakterier end med de kendte metoder. Det betyder dog også, at det er en udfordring at korrelere resultaterne til kendte værdier for mikrobiologiske analyser (dyrkning og tælling) af den simple grund, at de kendte analysemetoder har detekteret alt for få mikroorganismer - der har været for mange, der ikke har kunnet vokse frem. Teknologien kan desuden også tælle partikler i samme størrelsesorden som bakterier.
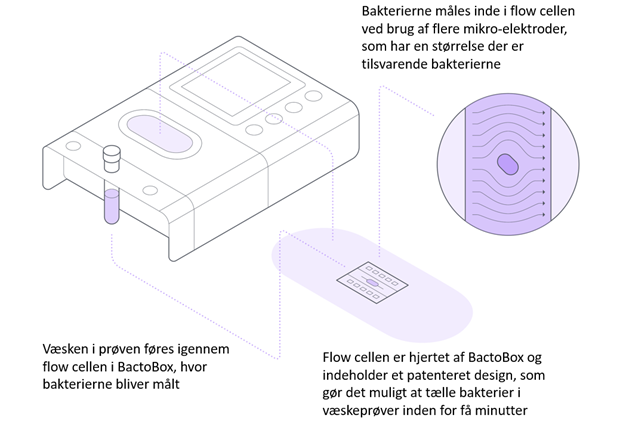
SBT Instruments – BactoBox
BactoBox er et helt nyt instrument, som bruger en dansk udviklet teknologi til at måle antallet af bakterier i væsker på få minutter. Teknologien er baseret på flowcytometri, som er en velkendt teknologi fra avancerede forskningslaboratorier. Princippet i målemetoden for BactoBox er vist i figur 2. BactoBox indeholder en flowcelle med et sæt af mikro-elektroder, som har samme størrelse som bakterier. Når en bakterie ”løber” hen over elektroderne, vil den blive detekteret af mikro-elektroderne. Partikler detekteres også, og tælles separat. Dermed er BactoBox i stand til at registrere de enkelte bakterier før de opformeres og give et svar på antallet af bakterier i prøven meget hurtigt. Der kræves ingen prøveforbehandling.Da teknologien måler enkeltceller uden dyrkning, vil BactoBox tælle alle bakterier, uanset om de er stressede, på sporeform eller hvordan deres foretrukne dyrkningsbetingelser er. Pga. problematikken ”viable-but-not-culturable” er det bestemt ikke sikkert, at disse bakterier vil kunne ses ved en opdyrkning på en agarplade (standardtest), men de kan stadig give problemer med fødevaresikkerhed og produktkvalitet. Det betyder samtidigt, at man vil se et højere bakterietal med BactoBox end med de traditionelle dyrknings og tælle metoder. Et højere resultat ved en BactoBox måling er ikke en indikation på at rengøringen er utilstrækkelig, men nærmere at den nye metode er mere sensitiv end de gamle, og at man dermed kan reagere tidligere, når der sker et skred i trendkurven.
Insatech – Total organisk carbon
Til rengøringskontrol af særlig vanskelige produktionsapparater eller skift mellem kritiske produkter kan Total Organisk Carbon (TOC) monitorering anvendes. TOC måleprincippet beror på at måle organisk carbon/kulstof. Kulstof er den kemiske byggesten i stort set alle materialer lige fra produktet i processen (fedt, protein, mikroorganismer) til nogle af de anvendte rengøringsmidler. Niveauet af TOC indikerer tilstedeværelse af organisk materiale i større eller mindre grad. Hvad enten det stammer fra rester af smuds, biofilm eller organiske rengøringsmidler efter endt rengøring kan det måles. Ved at sammenligne resultatet fra det rene vand med resultatet fra en måling af slutskyllevandet, vil små forskelle i indholdet af organisk kulstof kunne detekteres, helt ned i ppb niveau.Ved at måle på indholdet af kulstof i det sidste skyllevand efter rengøring, gives der hermed en værdi for indholdet af TOC i skyllevandet. Dermed kan det vurderes om rengøringsproceduren har været tilstrækkelig effektiv med fjernelse af rester af produkt eller andet organisk materiale, og kan derved bruges til at frigive produktionsapparat til næste batch. Sievers TOC analyzer kan fås til både laboratorie brug, samt online monitorering (jf. figur 3).

Korrekt valg af analyse og en god risikovurdering af udstyr, produktion og processer skal sikre, at de fastsatte grænseværdier for rengøringen er tilstrækkelig lave til at produktets kvalitet kan holde til den fastsatte udløbsdato, samt at fødevaresikkerheden er i top hele tiden.
Ved valg af analyse er det vigtigt at vurdere den nedre detektionsgrænse for den specifikke analyse – er det tilstrækkelig godt i forhold til den risikovurdering, der er udarbejdet for produktionen og produktionsudstyret?
Den efterfølgende vurdering af monitorerede resultater sker ved hjælp af de grænseværdier, der er fastsat i risikovurderingen og valideringsforløbet. Verifikationen af målte værdier fortsættes indtil ny validering af rengøringen foretages.
Hvornår er rengøringen tilstrækkelig god?
Der skal ligge en god risikovurdering af udstyr, produktion og processer til grund for, hvornår en rengøring til en pågældende produktion er tilstrækkelig god. Dette skal selvfølgelig sammenholdes med holdbarhedstest, så det sikres at produkter stadig er fødevaresikre og holder den ønskede kvalitet ved den fastsatte holdbarheds udløb.
Det er vigtigt at vælge analysemetoder, der giver en reel vurdering af rengøringens effektivitet. Er der altid ikke detekterbare resultater for en rengøringsvalidering bør det vurderes, hvorvidt analysemetoden er et korrekt valgt eller om den udtagne prøve er repræsentativ for produktionslinjen. Der ligger altså et stort arbejde i at skulle fastsætte, hvornår rengøringen er tilstrækkelig god. Det bliver dog nemmere, hvis der anvendes metoder, der er vurderet både hurtige og gode nok – også når der kræves en lav detektionsgrænse.
I projektet er begge nye metoder anvendt sammen med gængse mikrobiologiske metoder på 2 case virksomheder fra forskellige brancher indenfor fødevareindustrien. Der er kommet nogle spændende resultater ud fra den første case virksomhed, og den første halvdel af resultaterne fra case virksomhed 2 ser absolut også spændende ud. I næste artikel medtages de væsentligste resultater fra case virksomhed 1.
Artiklen blev først publiceret i Plus Proces i august 2020.





